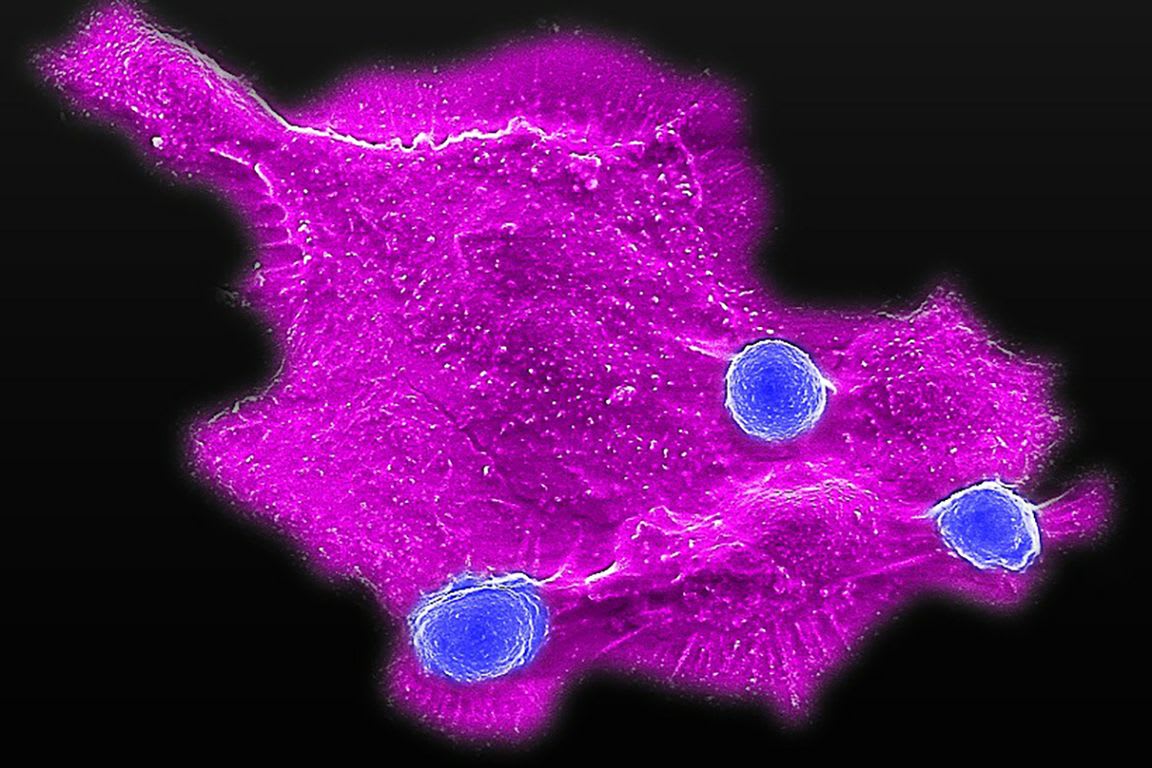
加州大学洛杉矶分校(UCLA)的研究人员开发出一种新型细胞疗法,有望彻底改变胰腺癌的治疗格局。胰腺癌作为致死率最高的恶性肿瘤之一,患者五年生存率仅为13%。这项发表于《美国国家科学院院刊》11月22日刊的研究显示,CAR-NKT细胞疗法在临床前模型中成功展现出追踪并摧毁原发性肿瘤和转移灶的双重能力。
与传统个性化CAR-T疗法相比,这种现成型疗法具有显著优势。现行CAR-T疗法每个患者需花费30万至47.5万美元,且需要数周制备时间;而新疗法可从捐赠的造血干细胞中规模化生产,单剂储存成本约5000美元。在完成所有临床前研究后,研究团队正准备向美国食品药品监督管理局提交临床试验申请。
突破实体瘤治疗壁垒
尽管CAR-T疗法在部分血癌治疗中取得革命性进展,但对胰腺癌等实体瘤却收效甚微。这类肿瘤会构建致密的保护屏障,阻碍治疗细胞抵达病灶。为攻克这一难题,资深研究员李丽阳博士团队创新性地利用恒定自然杀伤T细胞(NKT细胞),通过为其装备靶向间皮素的嵌合抗原受体,成功突破肿瘤防御机制。
第一作者李延瑞博士形象地描述:“我们构建了无死角的肿瘤包围网。即使癌细胞通过改变分子特征试图逃逸,我们的疗法也能同时从多个角度实施打击。”研究团队通过在胰腺原位肿瘤模型和肝转移模型(最常见的转移部位)中进行测试,证实CAR-NKT细胞具有卓越的肿瘤归巢能力,其高表达的趋化因子受体能精准引导治疗细胞抵达肺、胰腺等器官的肿瘤部位。
通用型治疗平台
由于NKT细胞天然具备与任何免疫系统兼容的特性,不会引发排斥反应,这使得单次捐赠即可生产足以满足数千次治疗所需的细胞。该疗法靶向的间皮素在乳腺癌、卵巢癌和肺癌中同样高表达,意味着同一细胞产品可能适用于多种癌症类型。
身为UCLA教授及琼森综合癌症中心成员的杨博士强调:“胰腺癌患者亟需更有效的治疗方案。我们开发的疗法兼具强效性、安全性、可扩展性和经济性。下一步关键是要在患者身上验证同等疗效。”